癌症已经成为威胁人类生命健康的主要疾病,化学疗法是目前治疗癌症最有效的手段之一。但化学疗法在杀伤肿瘤细胞的同时也会对正常组织和细胞产生严重的毒副作用。基于纳米技术的药物转运体系为降低化疗药物对正常细胞和组织的毒副作用提供了新的思路。由于纳米药物转运体系具有高通透和滞留效应(EPR effect),即被动靶向性,能够有效的主动/被动靶向肿瘤组织,因此促进了药物在肿瘤部位的累积和富集。然而,很多研究指出EPR效应并不是相对均一的。如何减轻化疗药物对正常组织的损害,同时进一步提高药物对肿瘤的专一性抑制效果是亟待解决的关键问题。相比被动靶向性,具有主动靶向功能的刺激响应型药物转运体系能够很大程度的降低药物分子对正常组织和细胞的毒副作用。因此,构筑具有主动靶向功能的刺激响应型药物转运体系不仅能够特异性的识别癌细胞,而且能够在外界刺激下将抗癌药物精准的释放。
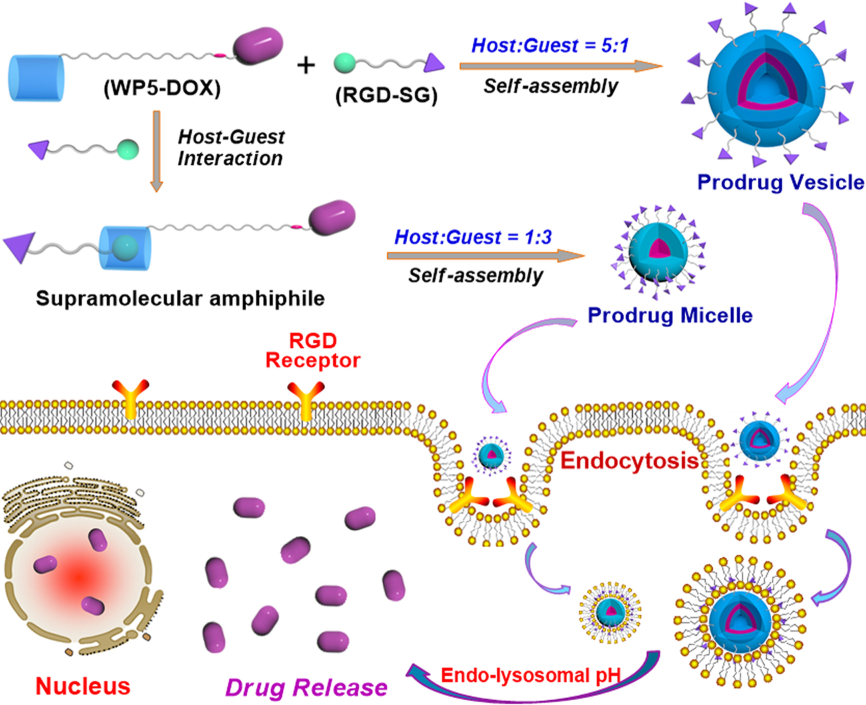
近期,胡晓玉教授课题组基于前期在“被动靶向性”纳米药物转运体系的研究基础上(J. Am. Chem. Soc., 2014, 136, 10762;Chem. Mater., 2016, 28,3778;Chem. Commun., 2018, 54, 9462),基于“肿瘤主动靶向”策略,致力于开展“靶向智能”型超分子纳米药物载体的构建及性能研究,成功构筑了具有主动靶向功能的刺激响应型药物转运体系。鉴于多肽不仅具有非常好的生物相容性,而且对很多癌细胞都具有特异的识别作用,胡晓玉教授利用酸敏感的腙键连接疏水抗癌药物阿霉素,合成了首例基于柱芳烃的前药主体分子,并且在磺酸盐客体分子的末端引入癌细胞靶向多肽—RGD(Arg-Gly-Asp),通过进一步的主–客体识别作用构筑了表面经靶向多肽RGD修饰的超分子前药纳米载体,实现高载药量的“靶向智能”超分子纳米药物载体的构筑。
该研究工作结合“药物共轭的前药双亲体”的理念,基于柱芳烃的主–客体化学作用构筑前药纳米载体的肿瘤靶向性策略,成功构筑了基于水溶性柱[5]芳烃前药衍生物和RGD修饰的磺酸盐的肿瘤靶向性前药纳米载体。如图所示,以水溶性柱[5]芳烃修饰的前药分子为主体(WP5-DOX),以RGD修饰的磺酸盐为客体分子(RGD-SG),构筑了超分子两亲体WP5-DOXRGD-SG。该两亲体能够自组装形成形态可控的超分子聚集体,并且在癌细胞的酸性环境刺激下,可以实现抗癌药物DOX的释放。同时,通过引入RGD修饰的磺酸盐客体RGD-SG来实现其主动靶向能力,其中磺酸基团能进入柱[5]芳烃的空腔。前药纳米粒子与RGD配体结合后可以特异性识别很多肿瘤细胞,例如其对黑色素瘤、胶质母细胞瘤、卵巢、乳腺癌和肝癌等癌细胞都具有很高的亲和力。因此,该纳米载体具有靶向运输DOX到表面过度表达RGD受体的癌细胞中。同时,研究发现纳米载体的形貌可以通过调控超分子两亲体的主、客体分子的摩尔比来实现从囊泡到胶束的转换。通过调控不同的主、客体比例来得到不同的形貌,从而可控地构筑基于相同的主–客体作用的不同形貌和尺寸的超分子纳米载体。细胞实验表明,这些纳米载体通过细胞的内吞作用能特异性的运输DOX到过度表达RGD受体的癌细胞中,此时腙键在酸性的溶酶体环境下断裂,促进DOX的快速释放,并在癌细胞内有效地积累。荷瘤鼠动物模型实验进一步证实,该体系不仅显著提高了对肿瘤组织增殖的抑制效果,而且能有效减轻化疗药物对小鼠正常组织的毒副作用,在抗癌药物的靶向转运中具有潜在的应用价值。因此,该体系实现了不仅能够特异性的识别癌细胞,而且能够在外界刺激下将抗癌药物精准释放的双重功能。
相关研究成果以“From Supramolecular Vesicles to Micelles: Controllable Construction of Tumor-Targeting Nanocarriers Based on Host–Guest Interaction between a Pillar[5]arene-Based Prodrug and a RGD-Sulfonate Guest”为题发表在德国Wiely出版社的TOP期刊Small上(影响因子9.598,全文链接:https://onlinelibrary.wiley.com/doi/full/10.1002/smll.201803952),并被评为当期的Hot Topic Paper。
该项工作由南京航空航天大学胡晓玉教授课题组与德国杜伊斯堡-埃森大学Carsten Schmuck教授课题组合作完成,该项研究得到了国家自然科学基金、江苏省自然科学基金和德国洪堡基金的资助。